در تازهترین نوآوری پزشکی، پژوهشگران موفق شدهاند با تزریق ژنهای سالم به جای ژنهای معیوب، نوعی نابینایی مادرزادی را درمان کنند. با تعمیم این روش میتوان به درمان کلیه بیماریهای نابینایی امیدوار بود.
محبوبه عمیدی: نابینایی، سرطان مغز و زندگی نباتی را میتوان سرسختترین چالشهایی به شمار آورد که علم پزشکی تاکنون پیش رو داشته و هنوز موفق به درمان آنها نشده است. شاید همین ناامیدی از راههای همیشگی باعثشده که اینبار پزشکان به سراغ درمانهای غیرمتعارف برای این بیماران بروند و آنطور که در گزارش پاپساینس میخوانید به پاسخهای امیدوارکنندهای دست پیدا کنند. در بخش اول این گزارش سهگانه به بازگرداندن بینایی میپردازیم.
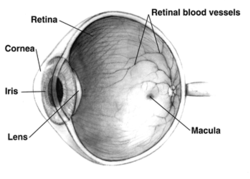
نام بیماری: LCA، یک بیماری ژنتیکی تهدیدکننده بینایی که با کاهش تدریجی قدرت بینایی در کودکان، موجب نابینایی آنها در سنین بزرگسالی میشود.
درمان قطعی: جایگزینی ژنهای ناقص با ژنهای همسان سالم
وضعیت درمان: تا اخذ تاییدیه از سازمان غذا و داروی ایالات متحده، اف.دی.ای، 3 تا 5 سال دیگر وقت لازم است.
تامی موهاوس، پیش از این میترسید با صدای زنگ ساعت، هر صبح چشمهایش را باز کند. بینایی او طی سهسال گذشته رو به زوال گذاشته بود و تنها چیزی که این روزها میدید به غباری قهوهای محدود میشد. امکان نداشت بتواند آسمان را از اقیانوس تفکیک کند، یا افراد را از روی چهرهاشان تشخیص دهد. خانم موهاوس که 45 سال دارد و مادر سه فرزند است، میدانست در نهایت همین اندک بینایی باقیمانده را نیز از دست خواهد داد و برای باقی عمر نابینا خواهد شد. اما تنها دوهفته پس از اینکه پزشکان ژنهای تازه را به یکی از چشمهای او تزریق کردند، توانست در یخچال را ببیند. تامی درست چهارماه بعد هم شاهد بازی دختر 12 سالهاش در زمین بیسبال بود.

مورهاوس به بیماری ژنتیکی نادری مبتلاست که ال.سی.ای یا نابینایی مادرزادی لبر نام دارد و به دلیل وجود نقص در ساختار تنها یک ژن ایجاد میشود. نقص در این ژن، شبکیه را از تولید پروتئینهایی که در حفظ سلامت گیرندههای نوری چشم نقشی حیاتی ایفا میکنند، باز میدارد. در بسیاری از مبتلایان به این بیماری، کاهش دید از همان سالهای ابتدایی کودکی آغاز میشود و بیهیچ درمانی، بدونشک تامی یا هر بیمار دیگری در نهایت نابینا خواهد شد. اما او آنقدر خوششانس بوده که یکی از 12 نفری باشد که توسط بیمارستان کودکان فیلادلفیا برای درمان انتخاب شدهاند.
دیگر بیماران از 8 تا 33 سال دارند، تامی به شوخی میگوید: «من مسنترین و نابیناترین داوطلب بودم». برای درمان، در یک مرحله به نزدیکی سلولهای شبکیه این داوطلبان ژنهای سالم تزریق شدهاند تا امکان ترمیم گیرندههای نوری چشم را فراهم کنند. با اینکه اغلب این داوطلبان با شرایطی مشابه تامی در این آزمون بالینی شرکت کردند، اما در حال حاضر بینایی 6 نفر از آنها به گونهای بهبود پیدا کرده که دیگر نابینا به شمار نمیآیند.
نحوه درمان

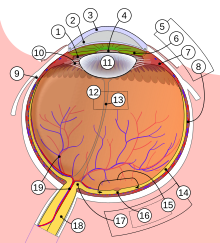
ویروس حامل رونوشتهایی از ژن سالم در نزدیکی سلولهای پوششی رنگدانهای شبکیه تزریق میشود. ویروس به این سلولها متصل میشود و ژن جدید را با تزریق به درون سلول، جایگزین ژن ناقص پیشین میکند. در نتیجه پروتئینهای مورد نیاز ساخته شده و به سلولهای مخروطی و استوانهای چشم کمک میکنند تا جذب نور را آغاز کنند. البته سلولهای استوانهای برای جذب نور همزمان به ویتامین A هم نیاز دارند.
 این درمان حاصل بیش از 20 سال تلاش جین بنت، نسلشناس مولکولی دانشکده پزشکی دانشگاه پنسیلوانیا روی نابینایی ارثی در موشها و سگها است. خانم بنت میگوید، با مطالعه بیشتر، ظرف مدت 3 سال آینده میشود دارویی تولید کرد که بتواند توسط جراحان شبکیه برای درمان قطعی ال.سی.ای مورد استفاده قرار بگیرد. اما باز هم این پایان راه نخواهد بود. تنها سالانه 5 کودک در ایالات متحده متولد میشوند که مادرزاد مبتلا به نوعی ال.سی.ای هستند که خانم مورهاوس هم از آن رنج میبرد، اما میتوان با تمرکز روی درمان نقص در تکژنهای کمیاب و با استفاده از این تکنیک به راهی تازه برای درمان بیماریهای چشمی شایعتری دست یافت. دکتر بنت میگوید: «موفقیت ما نشان میدهد که این تکنیک پاسخگو است. ما امیدواریم این روش بتواند تکنیک نهایی برای درمان انواع بیماریهای منجر به نابینایی باشد. در خلال یکدهه، درمان ژنی خواهد توانست به بهبود بینایی در بیماران مبتلا به التهاب رنگدانهای شبکیه یا تخریب لکه زرد که هر دو ناشی از جهشهای دیگری در ژنها هستند نیز کمک کند».
این درمان حاصل بیش از 20 سال تلاش جین بنت، نسلشناس مولکولی دانشکده پزشکی دانشگاه پنسیلوانیا روی نابینایی ارثی در موشها و سگها است. خانم بنت میگوید، با مطالعه بیشتر، ظرف مدت 3 سال آینده میشود دارویی تولید کرد که بتواند توسط جراحان شبکیه برای درمان قطعی ال.سی.ای مورد استفاده قرار بگیرد. اما باز هم این پایان راه نخواهد بود. تنها سالانه 5 کودک در ایالات متحده متولد میشوند که مادرزاد مبتلا به نوعی ال.سی.ای هستند که خانم مورهاوس هم از آن رنج میبرد، اما میتوان با تمرکز روی درمان نقص در تکژنهای کمیاب و با استفاده از این تکنیک به راهی تازه برای درمان بیماریهای چشمی شایعتری دست یافت. دکتر بنت میگوید: «موفقیت ما نشان میدهد که این تکنیک پاسخگو است. ما امیدواریم این روش بتواند تکنیک نهایی برای درمان انواع بیماریهای منجر به نابینایی باشد. در خلال یکدهه، درمان ژنی خواهد توانست به بهبود بینایی در بیماران مبتلا به التهاب رنگدانهای شبکیه یا تخریب لکه زرد که هر دو ناشی از جهشهای دیگری در ژنها هستند نیز کمک کند».
مورهاوس نیز مانند دیگر داوطلبان گروه اول تنها یک تزریق دریافت کرده است؛ چراکه چشم دیگر به عنوان شاهد باقی مانده تا تغییرات قابل پیگیری باشند. او میگوید: «میتوانید فکر کنید خیلی خودخواهم، اما من مرتب به پزشکم یادآوری میکنم که چشم دیگر مرا فراموش نکند».
بنت و همکارانش امیدوارند در بهار 1389، درمان را با تزریق ژنهای سالم به هر دو چشم بیماران کمسنتر ادامه دهند. بنت در حال حاضر تقاضای دریافت بودجه تکمیلی کرده و میخواهد درمان 12 داوطلب اول را نیز به پایان ببرد. او امیدوار است به زودی این بودجه را دریافت کند و میگوید: «ژنهای جدید نمیتوانند به یک باره تمامی سلولهای از دسترفته را احیا کنند. این یک تلاش هیجانانگیز برای همگی ماست».






 این درمان حاصل بیش از 20 سال تلاش جین بنت، نسلشناس مولکولی دانشکده پزشکی دانشگاه پنسیلوانیا روی نابینایی ارثی در موشها و سگها است. خانم بنت میگوید، با مطالعه بیشتر، ظرف مدت 3 سال آینده میشود دارویی تولید کرد که بتواند توسط جراحان شبکیه برای درمان قطعی ال.سی.ای مورد استفاده قرار بگیرد. اما باز هم این پایان راه نخواهد بود. تنها سالانه 5 کودک در ایالات متحده متولد میشوند که مادرزاد مبتلا به نوعی ال.سی.ای هستند که خانم مورهاوس هم از آن رنج میبرد، اما میتوان با تمرکز روی درمان نقص در تکژنهای کمیاب و با استفاده از این تکنیک به راهی تازه برای درمان بیماریهای چشمی شایعتری دست یافت. دکتر بنت میگوید: «موفقیت ما نشان میدهد که این تکنیک پاسخگو است. ما امیدواریم این روش بتواند تکنیک نهایی برای درمان انواع بیماریهای منجر به نابینایی باشد. در خلال یکدهه، درمان ژنی خواهد توانست به بهبود بینایی در بیماران مبتلا به التهاب رنگدانهای شبکیه یا تخریب لکه زرد که هر دو ناشی از جهشهای دیگری در ژنها هستند نیز کمک کند».
این درمان حاصل بیش از 20 سال تلاش جین بنت، نسلشناس مولکولی دانشکده پزشکی دانشگاه پنسیلوانیا روی نابینایی ارثی در موشها و سگها است. خانم بنت میگوید، با مطالعه بیشتر، ظرف مدت 3 سال آینده میشود دارویی تولید کرد که بتواند توسط جراحان شبکیه برای درمان قطعی ال.سی.ای مورد استفاده قرار بگیرد. اما باز هم این پایان راه نخواهد بود. تنها سالانه 5 کودک در ایالات متحده متولد میشوند که مادرزاد مبتلا به نوعی ال.سی.ای هستند که خانم مورهاوس هم از آن رنج میبرد، اما میتوان با تمرکز روی درمان نقص در تکژنهای کمیاب و با استفاده از این تکنیک به راهی تازه برای درمان بیماریهای چشمی شایعتری دست یافت. دکتر بنت میگوید: «موفقیت ما نشان میدهد که این تکنیک پاسخگو است. ما امیدواریم این روش بتواند تکنیک نهایی برای درمان انواع بیماریهای منجر به نابینایی باشد. در خلال یکدهه، درمان ژنی خواهد توانست به بهبود بینایی در بیماران مبتلا به التهاب رنگدانهای شبکیه یا تخریب لکه زرد که هر دو ناشی از جهشهای دیگری در ژنها هستند نیز کمک کند». سلام من فرنوش امینی هستم و این پسرم ارشاد هست.
سلام من فرنوش امینی هستم و این پسرم ارشاد هست.